La ferroportine a été découverte en 2000 chez un petit poisson, le "zebrafish" (poisson zèbre), un vertébré qui est largement utilisé dans les recherches génétiques. A peine une année plus tard, deux équipes rapportaient les premiers cas de maladie humaine liée à des mutations de l'équivalent de ce gène chez l'homme. Dans les deux cas, il s'agissait d'une surcharge en fer héréditaire qui différait nettement de l'hémochromatose génétique (HG) classique liée au gène HFE. La transmission était autosomique dominante (et non récessive comme dans l'HG classique). Le principal signe d'alerte était une hyperferritinémie sans élévation du coefficient de saturation de la transferrine (signe biologique fondamental pour le diagnostic classique d'HG). Les patients présentaient une surcharge en fer dont la localisation n'était pas celle habituellement retrouvée dans l'HG (le type de cellules surchargées dans le foie était différent). Enfin, les saignées étaient assez mal tolérées chez ces patients qui (contrairement aux personnes atteintes d'HG traitées par des saignées bien conduites) développaient une anémie. Tous ces signes faisaient de cette maladie une nouvelle entité, classée à part de l'hémochromatose, et ne répondant pas aux principaux critères du diagnostic d'HG.
Les recherches scientifiques ont conduit quelques années plus tard à de passionnantes découvertes sur le fonctionnement de cette protéine. En effet, la ferroportine est un maillon important dans la régulation du fer circulant dans notre organisme. Ceci est possible grâce à l'intervention du principal "régulateur" du métabolisme du fer, dont on a souvent parlé dans ce journal, l'hepcidine. L'hepcidine est capable de se lier à la ferroportine et le couple hepcidine-ferroportine rentre alors dans la cellule où la ferroportine sera détruite. Cette liaison conduit donc à l'inactivation de la ferroportine. Lorsque notre corps a besoin de fer, le niveau d'hepcidine est bas et la ferroportine laisse sortir le fer des cellules, s'il y a trop de fer, le taux d'hepcidine augmente et vient se fixer sur la ferroportine l'empêchant ainsi d'exporter le fer. Dans la "maladie ferroportine", des mutations de ce gène rendent la protéine incapable d'excréter le fer hors des cellules. Le fer est véritablement "séquestré" dans les cellules, il ne peut en sortir car la porte de sortie (la ferroportine) est fermée.
Plus récemment encore, de nouvelles données sont venues compliquer nos connaissances sur cette maladie. Des équipes ont, en effet, décrit plusieurs cas de patients porteurs de mutations du gène de la ferroportine, mais se présentant cliniquement comme des HG classiques (avec en particulier un coefficient de saturation très élevé et une bonne réponse aux saignées). Cette seconde forme de la maladie est liée à des mutations différentes sur ce même gène. Ces mutations ont pour effet de rendre la ferroportine "insensible" à l'action de l'hepcidine. Celle-ci ne peut plus exercer son rôle régulateur et, même en présence d'un excès de fer, la ferroportine continue d'excréter celui-ci en permanence.
Mais la frontière entre ces deux formes cliniques est parfois difficile à préciser. Une équipe américaine a proposé d'utiliser à nouveau le poisson dard-perche pour exprimer les mutations afin de savoir de quel type elles sont. Les résultats sont clairs pour certaines mutations et beaucoup moins pour d'autres…
En pratique, il est maintenant possible de faire le diagnostic de cette nouvelle forme de surcharge en fer héréditaire en recherchant des mutations sur le gène de la ferroportine. Il ne s'agit pas d'un examen de routine et, seuls, quelques laboratoires spécialisés effectuent cette recherche. Elle est justifiée chez des patients présentant une hyperferritinémie importante (au moins >1000), avec ou sans élévation du CST, chez lesquels, évidemment, toute autre cause d'hyperferritinémie ou de surcharge en fer a été éliminée. Il doit exister au moins une surcharge en fer hépatique (vue par IRM ou biopsie) et un élément important à rechercher est l'existence d'autres membres de la famille (parents, frères et sœurs ou enfants) présentant une hyperferritinémie du même type. Une fois le diagnostic porté chez le cas index, il faut insister, comme dans le cas de l'HG classique, sur l'importance de l'enquête et du dépistage familial.
Docteur Patricia Aguilar Martinez
Conseil génétique et biologie moléculaire
Centre de dépistage des maladies rares du fer et du globule rouge
Laboratoire d'hématologie, Hôpital Saint-Eloi, CHU de Montpellier
Transmission autosomique récessive : exemple hémochromatose liée au gène HFE: ici, le seul sujet malade est celui qui a reçu une "double" dose du gène muté (en noir), héritée de ses 2 parents, il est "homozygote". Les hétérozygotes sont dits "porteurs sains".
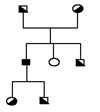
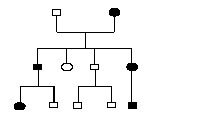
Transmission autosomique dominante : exemple maladie du gène ferroportine : ici, tous les sujets porteurs d'un gène muté (en noir) sont atteints, ils sont hétérozygotes. On ne connaît pas de sujet homozygote pour cette maladie.
Bulletin bimestriel AHF n° 96 - Mars-Avril 2008

